東協保健食品市場趨勢與法規概況工研院產經中心(IEK) / 陳麒元產業分析師
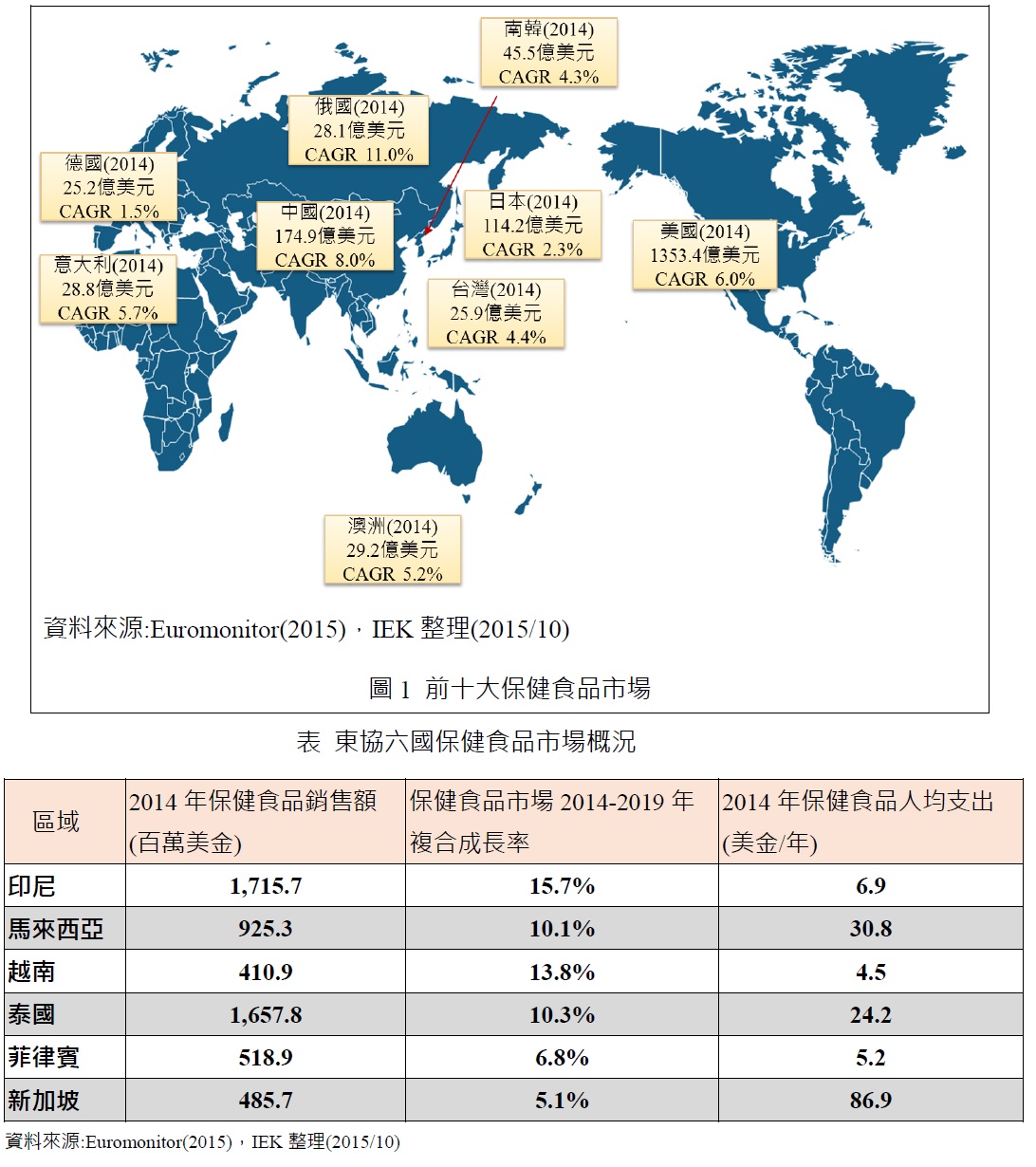
2015年全球保健食品市場規模達1,124.6億美金,其中亞太區仍是全球銷售第一的區域(2015年佔全球40.3%),北美地區排名第二(佔35.3%),西歐地區排名第三(佔11.3%),預估全球保健食品在2020年規模高達1574.4億美元,2015-2020年年複合成長率達7.0%,其中亞太區域在2015-2020新增市場銷售規模為201.3億美元(佔全球44.8%)排名第一,這說明未來五年的市場還是以亞太地區的市場成長潛力最大,並且2015-2020年年複合成長率也有7.6%之高。
以國家別來看,可以發現前十大保健食品國家以美國排名第一,其次為中國與日本,觀察前十大國家可以發現亞太地區就占了4個,若以廠商布局與成長率來看,亞太地區中的東協六國(印尼、泰國、菲律賓、越南、馬來西亞、新加坡)為廠商積極布局之市場,越南、印尼、泰國皆有5%以上之成長,未來市場可期。
一、亞太地區保健食品市場特性
觀察這個亞太地區的保健食品銷售情況,可以發現有幾個市場特性,分別是維他命與膳食補充品的產品定位以骨髂與美麗訴求高;大部分國家產品以草本素材為主,受當地傳統醫學或是漢方醫學影響深;收入提高帶動了健康意識抬頭,消費者願意購買保健食品意願高;產品以飲品型態接受度高;另外東協國家對於小包裝的訴求高,以下分別說明如下。
(一)產品訴求以骨頭保健與美麗訴求高
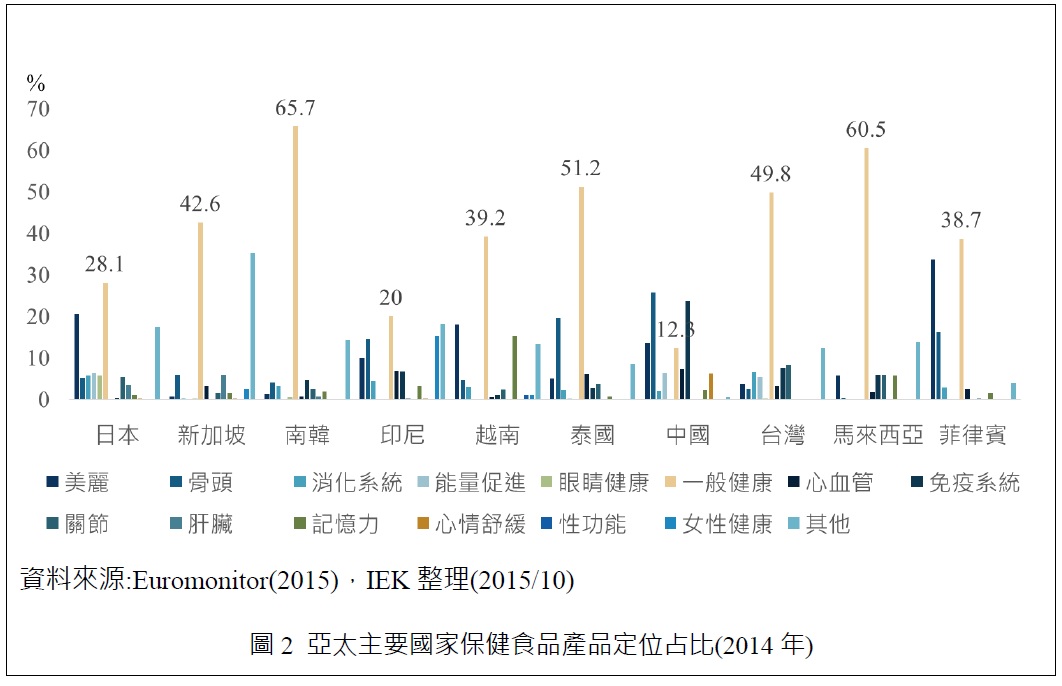
觀察維他命與膳食補充品的產品定位可以發現,除了一般健康類與其他類產品訴求外,各國在產品定位銷售占比方面有一些差異,像是日本美麗訴求產品銷售好;新加坡則是肝臟與骨骼保健;南韓則針對免疫系統與骨骼保健;印尼為女性健康、骨骼保健;越南則是美麗與記憶力訴求產品銷售為主;泰國為骨頭保健與免疫力相關產品訴求;中國則是以骨骼、免疫系統為主;台灣以關節與消化系統為主;馬來西亞以關節、美麗與記憶力為主;菲律賓以美麗與骨骼保健為主,詳情可看下圖2。
(二)大部分國家產品以草本素材為主
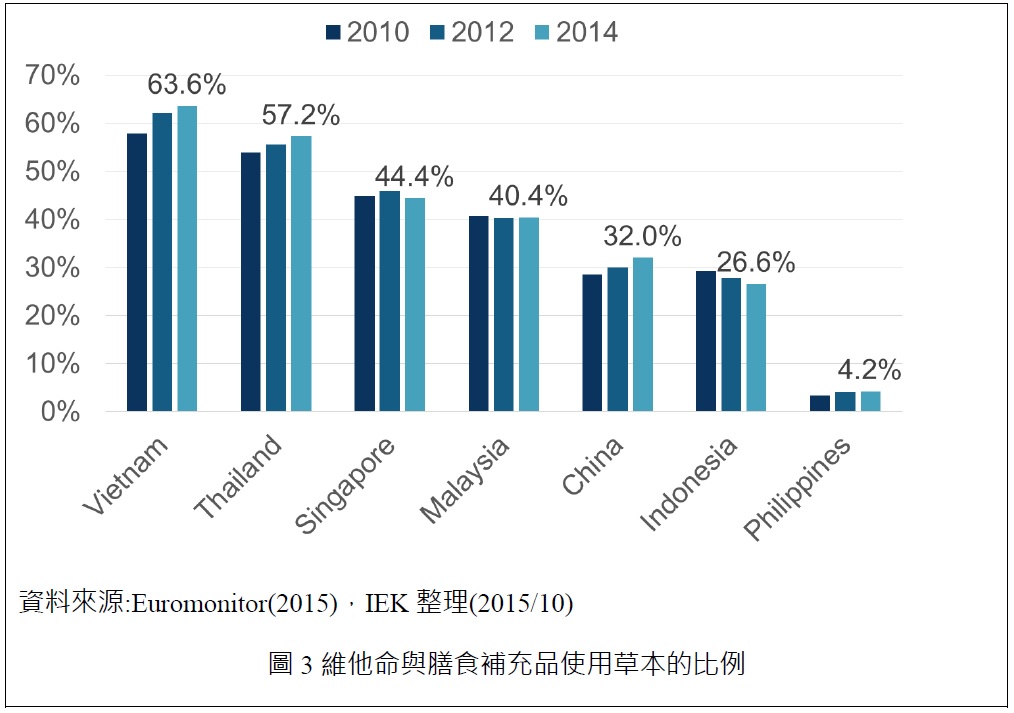
觀察維他命與膳食補充品的銷售產品使用素材可以發現,草本的使用比例有逐漸提高,但是以東協六國來看,菲律賓使用比例最低,越南跟泰國使用比例高,皆超過5成占比。
二、東協各國法規對於產品定義不同,需深入瞭解
對於保健食品來說,法規標準相當重要,產品是屬於食品、保健食品還是藥品,除了看成份與劑型外,也看各國衛生單位依據法規與個案審查認定。以下將針對東協的越南、印尼、菲律賓與泰國保健食品相關法規作說明。
(一)越南
越南法規定義健康食品為有補充各類維他命、礦鹽以及其他生物活性成份(Active ingredient)的營養物質的食品;獲原廠國或准許應市國的權責單位確認符合食品衛生安全法規,並具備下列條件時,獲視為健康食品:
1. 對於補充微量營養素(micronutrient)的食品:
如依照產品標籤上使用說明,每日送入人體的微量營養素至少含有1個維生素單位或礦鹽高於2002年國際推薦營養素攝入量RNI 2002(Recommended Nutrient Intakes)價值3倍時,必須持有原廠國權責單位確認該產品的安全性,並要在標籤或次標籤上清楚標示(對於進口食品)各類補充的營養物質滿足RNI標準。
2. 對含有生物活性成份(Active ingredient)的功能食品:
如公佈產品具備補助人體健康功能,增加人體抵抗力並減少患病危機等作用時,要有該產品的臨床實驗報告,或原廠國或准許應市國的權責單位發放的相關功能認證文件。而標籤或次標籤上必須加註”本食品並非藥物,不具替代治病藥物”字句。
3. 功能食品標籤內容要符合標籤法規定以及下列條件:
使用具備特殊功能產品的說明內容,要加註產品名稱(補充食品、健康保護食品、功能食品、瘦身食品、醫學營養食品等)、使用對象、產品功用、劑量、禁忌、特別要留意事項或副作用(若有)等。在越南國內生產但未確定是食品或藥品;含有尚無完整的科技資料證明其安全性及作用性的生物活性成份(Active ingredient)的食品等,食品安全局有責任配合越南藥品管理局和衛生部中醫事務司審查分類並統一管理。
4. 進口食品相關細則說明(2012年)
舉凡輸入越南所有食品、食品原料、食品附加劑等,均須接受越南權責機關執行國家檢驗,惟對於個人入境越南隨身攜帶屬於限量免課徵進口關稅之供消費的食品、使領館外交及領事袋內食品、過境及轉口食品、寄放海關關外食品、供實驗或研究用食品、供展覽陳列食品樣品,則免接受檢驗。
此外,前列第38/2012/NFD-CP號公告亦規定,對屬於機能食品、補充養分食品、保護健康食品、醫療用營養食品、增加微質食品、易遭微生物破壞的食品,均須強制標示「有效使用期限」、「使用至. .日截止」等字體,凡屬於有標示「有效使用期限」、「使用至. .日截止」的食品,當逾期時,不准在市場行銷。
對於其他類別的食品,可按食品類別要求標示「最佳於. . .日前使用」字體。對屬於有標示「最佳於. . .日前使用」字體的食品,當逾期時,若該食品製造商能向權責機關提出食品安全使用證明時,仍准予在市場行銷,惟另應選擇食品「有效使用期限」或「使用至. .日截止」字體的方式之一予以標示。
(二)印尼
根據印尼食品與藥物管理局(BPOM,NA-DFC)官方網站,進口保健食品可以透過網路進行線上查驗登記流程,雖然官網宣稱所需時間只需一個月,但在行政作業流程緩慢,未提供相關審查文件內容與範本,不主動通知送驗廠商缺漏或需補齊的文件,以及未說明樣本產品之送驗單位與檢驗流程等情況下,導致企業必須等待1~2年時間。不論進口或是當地生產之保健食品,必須申請POM號碼,每個POM號碼期效為5年。
印尼保健食品POM號碼由兩個英文字母合9個阿拉伯數字組成,分為兩大項6大類,SD開頭的號碼為印尼本地產品,SI開頭的號碼為進口產品,SL號碼為代工產品,TL為印尼本地草本產品,TI為進口草本產品,TR為草藥品。
(三)菲律賓
在法規分類上主要按照菲律賓衛生部在1991年公布的22號命令,其規定維生素脂含量限制,如果超過一定含量之限制將被視為藥品,規定為超過每日攝取量105%的脂溶性維生素或是超過每日攝取量150%的水溶性維生素皆視為藥品,須按照藥品規定進行申請。
菲律賓衛生部核准總計106種的傳統藥物和35種中草藥,並且也通過10種草本藥用植物經臨床證實有治療價值的植物,分別為akapulko or ringworm bush (Cassia alata)、ampalaya or bitter gourd/bitter melon (Momordica charantia)、bawang or garlic (Allium sativum)、bayabas or guava (Psidium guajava)、lagundi or 5-leaved chaste tree (Vitex negundo)、niyog-niyogan or Chinese honeysuckle (Quisqualis indica L.)、sambong or blumea camphora (Blumea balsamifera)、tsaang gubat (Ehretia microphylla Lam.)、pansit-pansitan (Peperomia pellucida) 與yerba buena or peppermint (Clinopodium douglasii)。
將保健食品進口至菲律賓時,通常需要取得進口許可證,根據不同的食品種類其所轄的主管機關也不同。其中進口業者、流通業者或是再包裝業者被課以具體的義務,包括需要取得「營業許可」(License to Operate=LTO)、自由銷售證明或其他同等效力文件,以及在菲國國內銷售所必需的許可證「產品登記證明」(Certificate of Product Registration=CPR)。上述的進口許可證都必須在商品進口通關之前取得,取得「產品登記證明」是當地進口商、代理商、經銷商的責任。
(四)泰國
在法規分類上如果有達到泰國衛生部所宣布的每日建議攝取含量(recommended daily intake ,RDI)就視為藥品,如無宣稱或是未達到RDI,就視為一般食品。如果被視為藥品的話,生產與進口相關產品就必須通過泰國衛生部的核准,在標籤上註記核准字號等相關資訊。但是泰國的RDI標準訂得相當低,可能在美國視為膳食補充品,但在泰國可能被歸類為藥品,必須在藥局銷售。
要得到泰國衛生部的核准標誌,廠商必須提交相關申請文件,包含原料成分、製造工藝、安全生產相關證明文件與可能之副作用,並且提供宣稱有效功能之相關法律證明文件。
自2007年11月後,不管是進口還是本地生產之保健食品,產品包裝上必須註明相關資訊,泰國衛生部所宣布的消費者所被建議的五大類食品的一天攝取量,此外也需特別註明此產品不能治療與預防疾病等字樣。監管制度趨於嚴格,以往模糊地帶作法越來越不可行。
以法規制度來說,東協各國標準逐漸完善,監管制度趨於嚴格,且相關監管機關權責越來越明確,對台灣廠商來說,以往遊走灰色地帶的方式將越來越難,故建議廠商進入東協之前,需注意下列事項:
1.隨時關注法令規章制度之變動,避免卡關與退件之風險
廠商必須不斷追蹤觀察法令規章之變化,報關主要會碰到的問題為產品包裝、產品成分、產品劑型,這些都是影響申請與通關的關鍵。
2.審核人員主觀裁量權無統一標準,須預留彈性時間
例如在申請產品進口準證時,因審核時間不確定性高,須預留彈性時間降低審批時間過長的風險。









